克罗恩病
分類:消化科
上傳者:
浏览数:15894次
相關說明:
克羅恩病(Crohn's Disease , CD)是一種病因不明確的非特異性胃腸道炎性肉芽腫疾病,可累及胃腸道任何部位,病因尚未明確,可能與遺傳、環境、感染等諸多因素綜合作用后導致的免疫功能紊亂有關,具有急性發作與緩解交替出現的特征。
流行病學提示:我國在發病率上雖低于西方國家,但近年報道發病人數逐步增多,最常發生于青年期,發病高峰年齡為18~35歲,男性略多于女性(男:女約為1.5:1)。危險因素包括基因、吸煙、家族史等。
一、臨床癥狀
CD的臨床表現呈多樣性,包括消化道表現、全身性表現、腸外表現及并發癥。
1. 消化道表現
主要有腹瀉和腹痛,可有血便。
2. 全身性表現
主要有體質減輕、發熱、食欲不振、疲勞、貧血等,青少年患者可見生長發育遲緩。
3. 腸外表現
可包括皮膚黏膜表現(如口腔潰瘍、結節性紅斑和壞疽性膿皮病)、關節損害(如外周關節炎、脊柱關節炎等)、眼部病變(如虹膜炎、鞏膜炎、葡萄膜炎等)、肝膽疾病(如脂肪肝、原發性硬化性膽管炎、膽石癥等)、血栓栓塞性疾病等。
4. 并發癥
瘺管、腹腔膿腫、腸狹窄和梗阻、肛周病變(肛周膿腫、肛周瘺管、皮贅、肛裂等),較少見的有消化道大出血、急性穿孔,病程長者可發生癌變。
【注】肛周膿腫和肛周瘺管可為少部分CD患者的首診表現。
二、診斷標準
CD的診斷缺乏金標準,需要結合臨床表現、內鏡、影像學和病理組織學進行綜合分析并隨訪觀察。
三、輔助檢查
1. 實驗室檢查
血常規、C反應蛋白(CRP)、血沉(ESR)。CD患者全血細胞計數最常見的改變是貧血和血小板增多。CRP 和ESR 是代表急性炎癥反應指標。有研究示CD患者ESR 升高的占75.0%,CRP 升高的占66.7%,治療后ESR、CRP
均明顯下降。
2. 內鏡檢查
1) 結腸鏡檢查
結腸鏡檢查和活檢應列為CD診斷的常規首選檢查,鏡檢應達末段回腸。鏡下一般表現為節段性、非對稱性的各種黏膜炎性反應,其中具特征性的表現為非連續性病變、縱行潰瘍和卵石樣外觀比。
【注】 必須強調,無論結腸鏡檢查結果如何(確診CD或疑診CD),均需選擇有關檢查明確小腸和上消化道的累及情況,以便為診斷提供更多證據及進行疾病評估。
2) 小腸膠囊內鏡檢查(SBCE)
優點:對發現小腸黏膜異常相當敏感;
缺點:對一些輕微病變的診斷缺乏特異性,且有發生滯留的危險。主要適用于疑診CD但結腸鏡及小腸放射影像學檢查陰性者。
【注】 SBCE檢查陰性,傾向于排除CD;陽性結果需綜合分析并常需進一步檢查證實。
3) 小腸鏡檢查
我國常用的是氣囊輔助式小腸鏡(BAE)。可直視下觀察病變、取活檢及進行內鏡下治療,但為侵入性檢查,有一定并發癥的風險。主要適用于其他檢查(如SBCE或放射影像學)發現小腸病變;或盡管上述檢查陰性,但臨床高度懷疑小腸病變,需進行確認及鑒別者;或已確診CD需要BAE檢查以指導或進行治療者。小腸鏡下CD病變特征與結腸鏡所見相同。
4) 胃鏡檢查
少部分CD病變可累及食管、胃和十二指腸,但一般很少單獨累及。原則上胃鏡檢查應列為CD的檢查常規,尤其是有上消化道癥狀者。
3. 影像學檢查
1) CT或磁共振腸道顯像(CTE/MRE)
CTE/MRE是腸炎性病變的標準影像學檢查,有條件的單位應將此檢查列為CD診斷的常規檢查。
活動期CD的CT表現為:腸壁明顯增厚(>4mm);腸黏膜明顯強化,并伴隨腸壁分層改變,黏膜內環和漿膜外環明顯強化,呈“靶征”或“雙暈征”;腸系膜血管增多、擴張、扭曲,呈“木梳征”;相應系膜脂肪密度增高、模糊;腸系膜淋巴結腫大等。
【注】上述檢查可更好地擴張小腸尤其是近段小腸,更有利于高位CD病變的診斷。另外,盆腔磁共振有助于確定肛周病變的位置和范圍、了解瘺管類型及其與周圍組織的解剖關系。
2) 鋇劑灌腸及小腸鋇劑造影
鋇劑灌腸遇腸腔狹窄無法繼續進鏡者仍有診斷價值。小腸鋇劑造影敏感性低,但對無條件進行CTE檢查的單位,仍是小腸病變檢查的重要技術。該檢查對腸狹窄的動態觀察可與CTE/MRE互補,必要時可兩種檢查方法同用。
3) 腹部超聲檢查
腹部超聲檢查對發現瘺管、膿腫和炎性包塊具有一定價值,但對CD診斷準確性較低,超聲造影及彩色多普勒可增加準確性。
4. 黏膜活檢病理組織學檢查
黏膜活檢病理組織學檢查需多段(包括病變部位和非病變部位)、多點取材,病理改變包括:
1) 固有膜炎性細胞呈局灶性不連續浸潤;
2) 裂隙狀潰瘍;
3) 阿弗他潰瘍;
4) 隱窩結構異常,腺體增生,個別隱窩膿腫,黏液分泌減少不明顯,可見幽門腺化生或潘氏細胞化生;
5) 非干酪樣壞死性肉芽腫;
6) 以淋巴細胞和漿細胞為主的慢性炎性細胞浸潤,以固有膜底部和黏膜下層為重,常見淋巴濾泡形成;
7) 黏膜下淋巴管擴張;
8) 神經節細胞增生和(或)神經節周圍炎。
5. 手術切除標本
沿縱軸切開腸系膜,對側緣手術切除腸管,連同周圍淋巴結一起送病理組織學檢查。其表現包括:
1) 可見腸管局限性病變、跳躍式損害、鵝卵石樣外觀、腸腔狹窄、腸壁僵硬等特征;
2) 可見透壁性炎癥、腸壁水腫、纖維及系膜脂肪包繞病變腸段等改變;
3) 局部淋巴結有肉芽腫的形成。
另外,其在顯微鏡下典型改變還包括:
1) 透壁性散在分布淋巴樣細胞增生和淋巴濾泡形成;
2) 黏膜下層水腫和淋巴管擴張,晚期黏膜下層增寬或出現黏膜與肌層融合;
3) 非干酪樣壞死性肉芽腫見于黏膜內、黏膜下、肌層甚至腸系膜淋巴結;
4) 肌間神經節細胞和神經纖維增生和神經節周圍炎。
【注】非干酪樣壞死性肉芽腫具有較大的診斷價值,但需排除腸結核。
四、診斷要點
1) 具備典型臨床表現者可臨床疑診,安排進一步檢查;
2) 同時具備上述結腸鏡或小腸鏡(病變局限在小腸者)特征以及影像學(CTE或MRE,無條件者采用小腸鋇劑造影)特征者,可臨床擬診;
3) 如再加上活檢提示CD的特征性改變且能排除腸結核,可作出臨床診斷;
4) 如有手術切除標本(包括切除腸段及病變附近淋巴結),可根據標準作出病理確診;
5) 對無病理確診的初診病例,隨訪6~12個月以上,根據對治療的反應及病情變化判斷,符合CD自然病程者,可作出臨床確診。如與腸結核混淆不清但傾向于腸結核者,應按腸結核進行診斷性治療8~12周,再行鑒別。
WHO推薦的CD診斷要點
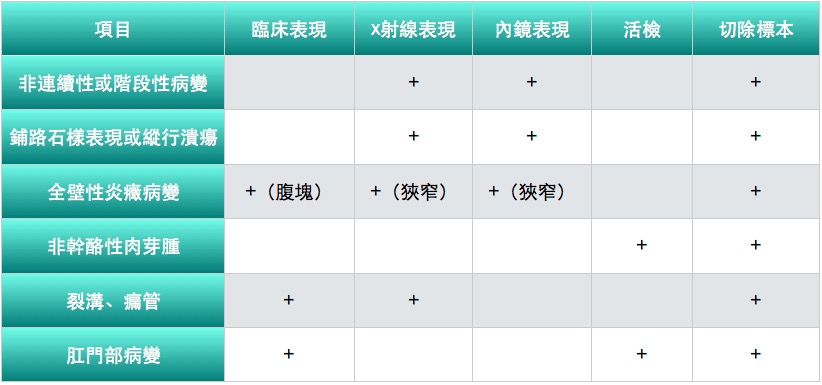
【注】具有①、②、③者為疑診;再加上④、⑤、⑥三者之一可確診;具備第④項者。只要加上①、②、③三者之二亦可確診;應用現代技術CT或磁共振腸道顯像檢查多可清楚顯示全壁炎而不必僅局限于發現狹窄。
五、鑒別診斷
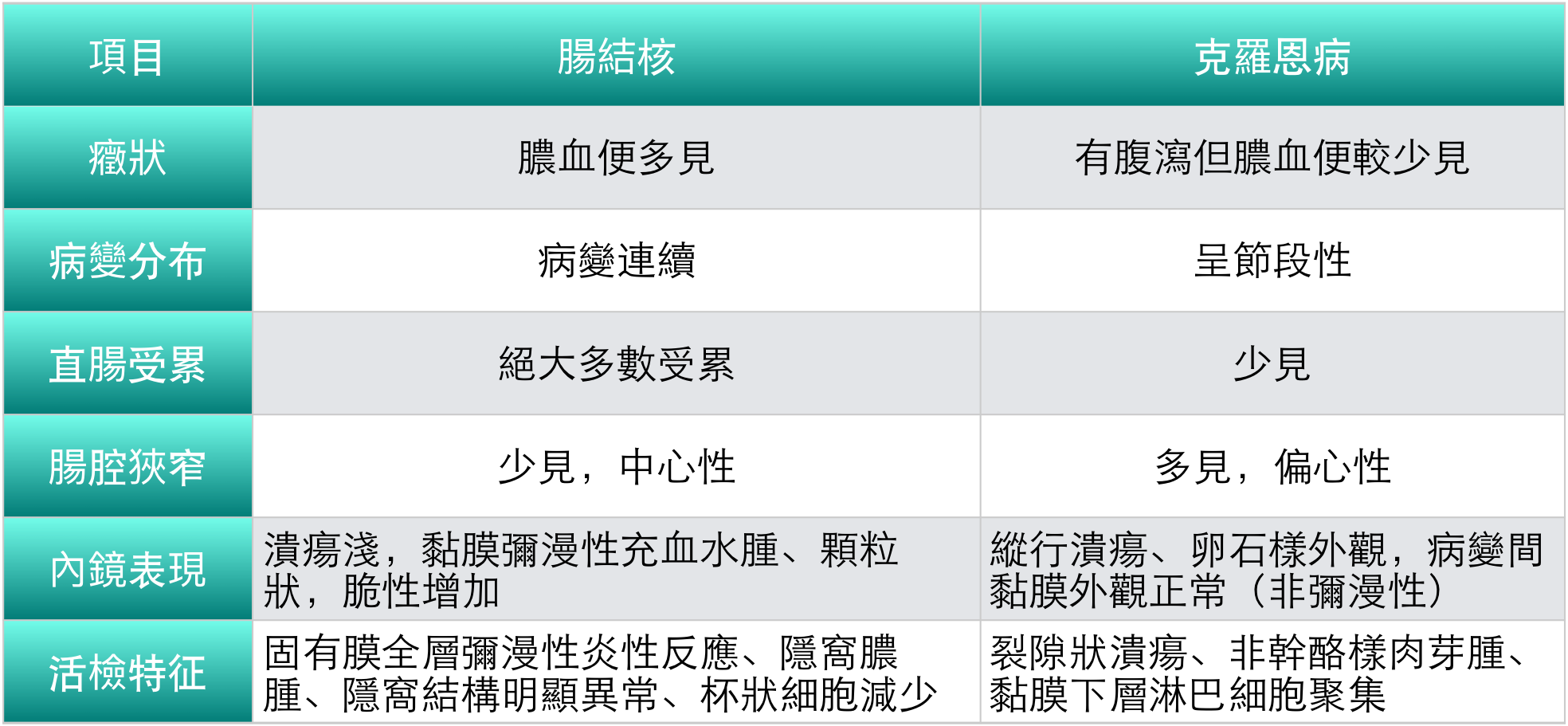
1. 腸結核
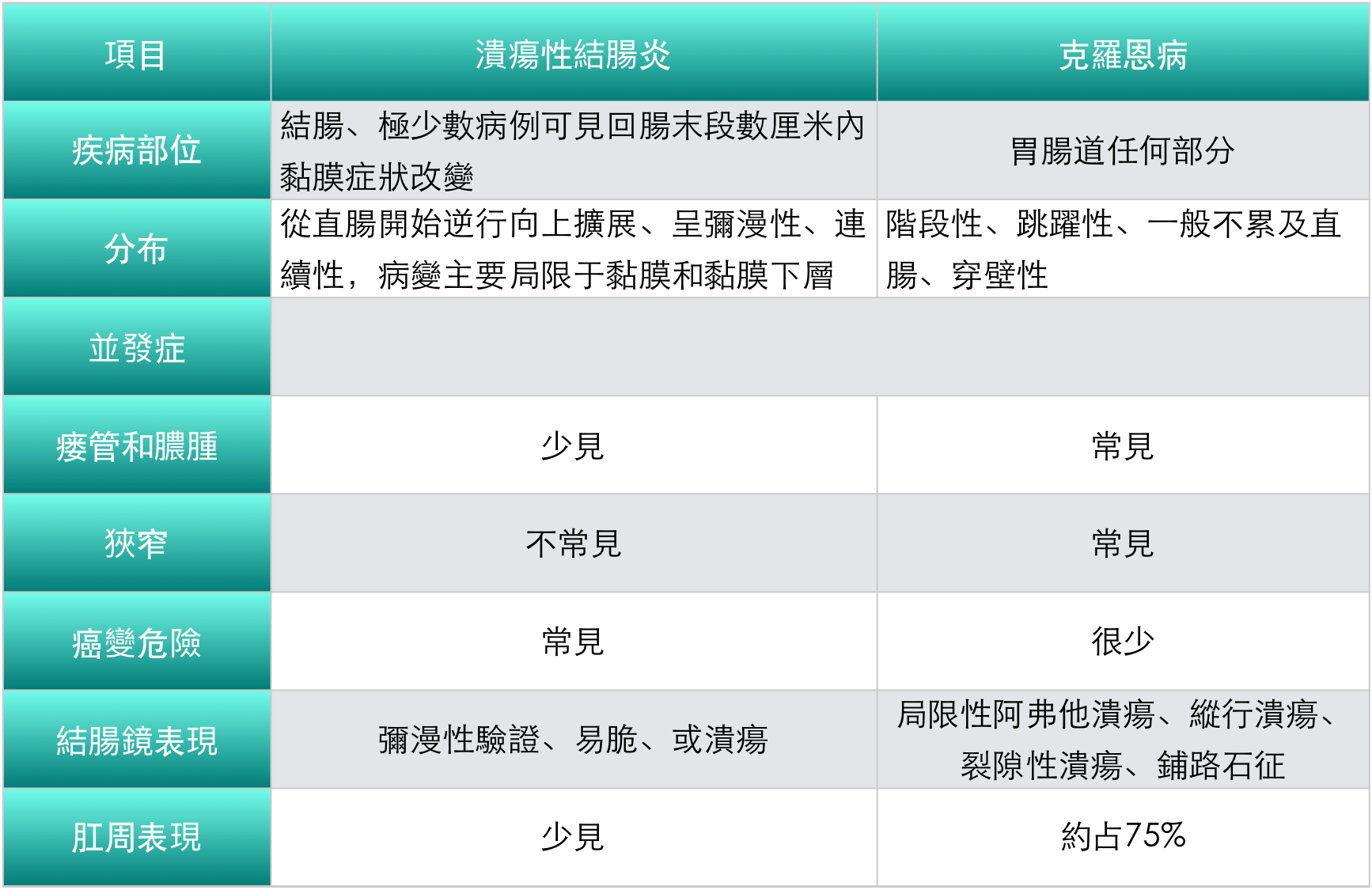
2. 潰瘍性結腸炎
六、疾病評估
1. 推薦按蒙特利爾CD表型分類法進行分型
臨床類型:非狹窄非穿通型(B1),狹窄型(B2),穿透型(B3),伴有肛周病變型(P)。
病變部位:回腸末端(L1),結腸(L2),回結腸(L3),上消化道(L4)。
嚴重層度:根據臨床表現的程度及并發癥計算CD活動指數,用于區分疾病活動期于緩解期、評估病情嚴重層度(輕、中、重)和評估療效。
2. 疾病活動性的嚴重程度
臨床上常用簡化的克羅恩病活動指數(Crohn’S disease activity index, CDAI)評估疾病活動性的嚴重程度以及進行療效評價。
簡化CDAI計算法
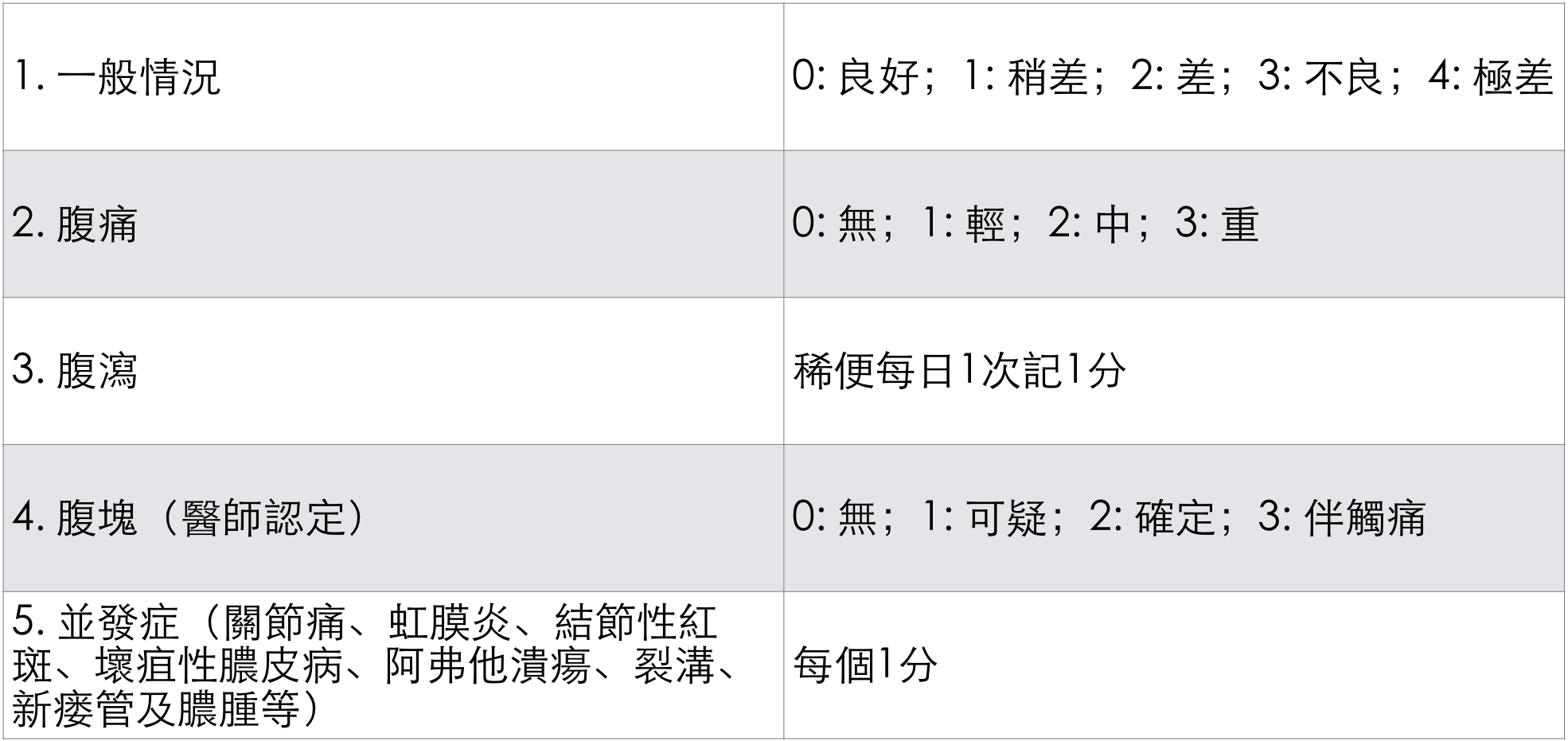
【注】≤4分為緩解期;5~8分為中度活動期;≥9分為重度活動期。
七、治療
1. 一般治療
1)必須要求患者戒煙;
2)營養支持。
2. 藥物治療方案的選擇
1) 輕度活動性CD的治療
① 氨基水楊酸制劑:適用于結腸型、末段回腸型和回結腸型,可應用美沙拉嗪。
② 布地奈德:病變局限在回腸末段、回盲部或升結腸者,布地奈德療效更優。
【注】對上述治療無效的輕度活動性CD患者應視為中度活性CD。
2) 中度活動性CD的治療
① 激素:治療首選。
② 激素與硫嘌呤類藥物或甲氨蝶呤(metho-trexate,MTX)合用:主要是在激素誘導癥狀緩解后,繼續維持撤離激素的緩解。硫唑嘌呤(AZA)與6-巰基嘌呤(6-MP)同為硫嘌呤類藥物,使用AZA出現不良反應的患者轉用6-MP后,部分患者可以耐受。硫嘌呤類藥物無效或不能耐受者,可考慮換用MTX。
③ 生物制劑:英夫利西單抗(IFX),用于激素及上述免疫抑制劑治療無效或激素依賴者,或不能耐受上述藥物治療者。
④ 其他:氨基水楊酸類制劑對中度活動性CD療效不明確。環丙沙星和甲硝唑僅用于有合并感染者。其他免疫抑制劑、沙利度胺、益生菌、外周血干細胞或骨髓移植等治療CD的價值尚待進一步研究。美沙拉嗪局部治療在有結腸遠端病變者必要時可考慮。
3) 重度活動性CD的治療
① 確定是否存在并發癥:局部并發癥如膿腫或腸梗阻,全身并發癥如機會感染。強調通過細致檢查盡早發現并做相應處理。
② 全身作用激素:口服或靜脈給藥,劑量為相當于潑尼松0.75~1 mg·kg-1·d-1。
③ IFX:視情況,可在激素無效時應用,亦可一開始就應用。
④ 手術治療:激素治療無效者可考慮手術治療。
⑤ 綜合治療:合并感染者予廣譜抗菌藥物或環丙沙星和(或)甲硝唑。視病情予輸液、輸血及輸白蛋白。視營養狀況及進食情況予腸外或腸內營養支持。
4) 特殊部位CD的治療
① 廣泛性小腸病變的治療:存在廣泛性小腸病變(累計長度>100cm)的活動性CD常導致營養不良、小腸細菌過度生長、因小腸多處狹窄而多次手術造成短腸綜合征等嚴重而復雜的情況,因此早期即應予積極治療,如早期應用免疫抑制劑(AZA、6-MP、MTX),對病情重或復發者早期考慮予IFX。營養治療應作為重要輔助手段。輕度患者可考慮試用全腸內營養作為一線治療。
② 食管和胃十二指腸病變的治療:食管、胃、十二指腸CD可單獨存在,亦可與其他部位CD同時存在。其治療原則與其他部位CD相仿,不同的是:加用質子泵抑制劑對改善癥狀有效;該類型CD一般預后較差,宜早期應用免疫抑制劑(AZA、6-MP、MTX),對病情重者考慮早期予IFX。
3. 藥物誘導緩解后的維持治療
應用激素或生物制劑誘導緩解的CD患者往往需要繼續長期使用藥物,以維持撤離激素的臨床緩解。激素依賴的CD是維持治療的絕對指征。其他情況宜考慮維持治療,包括:重度CD藥物誘導緩解后、復發頻繁CD、臨床上有被視為有“病情難以控制”高危因素等。
【注】 “病情難以控制”的高危因素包括:合并肛周病變、廣泛性病變(病變累及腸段累計>100cm)、食管胃十二指腸病變、發病年齡輕、首次發病即需要激素治療等。
用于維持緩解的主要藥物如下:
1) 氨基水楊酸制劑
使用氨基水楊酸制劑誘導緩解后仍以氨基水楊酸制劑作為緩解期的維持治療。氨基水楊酸制劑對激素誘導緩解后維持緩解的療效未確定。
2) 硫嘌呤類藥物或MTX
AZA是激素誘導緩解后用于維持緩解最常用的藥物。AZA不能耐受者可試換用6-MP。硫嘌呤類藥物無效或不能耐受者,可考慮換用MTX。上述免疫抑制劑維持治療期間復發者,首先要檢查藥物依從性及藥物劑量是否足夠,以及其他影響因素。如存在,做相應處理;如排除,可改用IFX誘導緩解并繼以IFX維持治療。
3) IFX
使用IFX誘導緩解后應以IFX維持治療。
4. 肛瘺的處理
首先要通過癥狀和體檢,尤其是麻醉下肛門指檢(EUA),并結合影像學檢查,如MRI和(或)超聲內鏡或經皮肛周超聲檢查等了解是否合并感染以及瘺管的解剖結構。
如有膿腫形成必須先行外科充分引流,并予抗菌藥物治療。無癥狀的單純性肛瘺無需處理。有癥狀的單純性肛瘺以及復雜性肛瘺首選抗菌藥物如環丙沙星和(或)甲硝唑治療,并以AZA或6-MP維持治療。應由肛腸外科醫師根據病情決定是否需要手術以及術式的選擇。
5. 外科手術治療及術后復發的預防
1) 外科手術指征如下
① 合并CD并發癥:腸梗阻、腹腔膿腫、瘺管形成、急性穿孔、大出血、癌變。
② 內科治療無效:激素治療無效的重度CD,內科治療療效不佳和(或)藥物不良反應已嚴重影響生存質量者。
2) 術后復發的預防
① 對有術后早期復發高危因素的患者宜盡早(術后2周)予積極干預;
② 術后半年、1年時及之后定期行腸鏡復查,根據內鏡復發與否及程度給予或調整藥物治療。
八、癌變的監測
小腸CD炎性反應部位可能并發癌腫,應重點監測小腸;結腸CD癌變危險性與UC相近,監測方法相同。
參考文獻:
[1] 中華醫學會消化病學分會炎癥性腸病學組.炎癥性腸病診斷與治療的共識意(2012 年?廣州)[J].中華內科雜志,2012,51(10): 818-831.
[2] 黎介壽. 認識克羅恩病的特性[J]. 中國實用外科雜志,2013,33(7): 535-537.
[3] 陸星華. 克羅恩病的診治進展[J]. 現代消化及介入診療,2010,15(4): 230-235.
[4] 郭翔廷,劉占舉. 克羅恩病的藥物治療進展[J]. 檢驗醫學臨床,2015,12(2): 247-251.
[5] 楊雪松,張蕾,石雪迎,張云莉,呂愈敏. 克羅恩病的診療現狀及臨床、病理特點[J]. 北京大學學報(醫學版),2006,38 (4): 407-410.